Autorin: Antje Sieb
Eingriffe in die menschliche Keimbahn: kein Tabu mehr?
Genomchirurgie, der gezielte Eingriff in unser Erbmaterial, scheint mit der Entdeckung neuer Werkzeuge wie CRISPR/Cas in greifbare Nähe gerückt zu sein.
Bei einer Befruchtung im Reagenzglas könnte man theoretisch im Erbmaterial eines zukünftigen Kindes Korrekturen vornehmen, Veränderungen, die dann von Generation zu Generation weitergegeben würden – ein sogenannter Keimbahneingriff. Entsprechende Experimente mit menschlichen Embryonen, die in Deutschland verboten wären, sind anderswo längst im Gange.
Genetisch veränderte Babys
Auch wenn die Forschung bisher nur im Labor stattfindet – für immer mehr Wissenschaftler scheint ein genetisch verändertes Baby zwar momentan noch nicht möglich, aber für die Zukunft keineswegs ausgeschlossen zu sein.
Erbkrankheiten ausmerzen, die Erfolge der Reproduktionsmedizin verbessern: Was wollen Forscherinnen und Forscher mit ihren Experimenten erreichen – und wie weit dürfen sie dabei gehen?
Sendung als Podcast
Download Funkkolleg Biologie und Ethik (05), MP3-Audioformat, 26:17 Min., 48.1 MB
Sendung in hr-iNFO: 25.11.2017, 11:30 Uhr
Zusatzmaterial
- Genchirurgie
- Genschere und Off-target-Effekte
- Entwicklungsgenetik
- Stammzellenforschung
- Embryonenforschung, Embryonenschutzgesetz
- Reproduktionsmedizin
- Präimplantationsdiagnostik
- Keimbahntherapie
- Sichelzellenanämie
- HIV-Resistenz
- Mitochondrienspende
1. Genchirurgie – Hoffnung auf Heilung
Die SWR-Wissens-Seiten geben eine leicht verständliche Einführung in die Möglichkeiten der medizinisch angewandten Genchirurgie.
Auch die hr-Info-Seiten bieten einen interessanten Artikel zum Einstieg ins Thema „Genchirurgie in der medizinischen Forschung“.
Eine aktuelle Werbebroschüre der Bayer-Forschung enthält ebenfalls anschauliche Abbildungen zu den medizinisch-pharmazeutischen Anwendungen der Genchirurgie und im Speziellen auch für die Behandlung von Hämophilie (Bluterkrankheit):
https://www.research.bayer.de/de/haemophilie-behandeln-research31.pdfx
Ein aktueller Beitrag aus dem Oktober 2017 beschreibt eine neue Methode, bei der nicht mehr „geschnitten“, sondern gleich über eine Korrektur in der RNA „umgewandelt“ wird:
http://www.br.de/themen/wissen/genome-editing-crispr-cas-genschere-keimbahntherapie-100.html
Genchirurgie beim menschlichen Embryo
Ein Video mit der Debatte über „Genchirurgie beim menschlichen Embryo“ im Rahmen der Jahrestagung des Deutschen Ethikrates (ca. 30 min) ist hier einsehbar:
Auf dem gemeinsam von Wissenschaft im Dialog (WiD), dem Science Media Center Germany (SMC) und der Technische Universität Braunschweig betriebenen Wissenschaftskommunikationsportal die-debatte.org findet sich gleich eine ganze Themenseite mit zahlreichen sehr aktuellen Beiträgen zur Genchirurgie:
https://www.die-debatte.org/thema/genchirurgie/
2. Genschere und Off-target-Effekte: unkontrollierbare Gefahren?
In „Nature Methods“ ist kürzlich ein Artikel zu den potenziellen Gefahren solcher „Off-Target“-Effekte der Genschere erschienen (als Off-Target-Effekte bezeichnet man Gene, die verändert werden, obwohl sie selbst nicht das Ziel der Genschere sind):
http://www.nature.com/nmeth/journal/v14/n6/full/nmeth.4293.html
Diese Studie (und die Kritik darin) wird in einem Artikel des Tagesspiegels zusammengefasst:
Eine allgemeinverständliche Beschreibung der aktuell möglichen Eingriffsarten per „Genschere“ und ein kurzer Abriss über die Risiken der unerwünschten, aber bisher weitgehend unkontrollierbaren „Off-target-Effekte“ gibt ein Artikel des SPIEGEL aus dem Oktober 2017:
http://www.spiegel.de/wissenschaft/medizin/genschere-crispr-cas9-schoener-schneiden-a-1174818.html
Einen englischsprachigen Artikel über die Schwächen der CRISPR-Genschere und die Möglichkeiten der Detektierung möglicher Off-target-Effekte sowie Empfehlungen zur Weiterentwicklung der Methodik haben Zang et al. im Jahr 2015 in der Fachzeitschrift „Molecular Therapy“ veröffentlicht.
http://www.sciencedirect.com/science/article/pii/S216225311630049X
Wo wird an der Verbesserung der Genschere geforscht?
Wo wird an der Verbesserung dieses biomedizinischen Tools geforscht? Zum Beispiel am Zentrum für chronische Immundefizienz der Universität Freiburg:
https://www.uniklinik-freiburg.de/cci/forschung/toni-cathomen/research-areas.html
Es gibt bereits Erkenntnisse darüber, wie z.B. ein virales Protein die Genauigkeit der Genschere steigern kann, indem es Off-target-Effekte verhindert:
3. Entwicklungsgenetik – wie bildet sich lebensfähiger Organismus?
Die Entwicklungsgenetik analysiert die Rolle der Gene während der ontogenetischen Entwicklung. Das Ziel ist es, zu verstehen, wie die genetische Ausstattung eines Organismus in die Bildung eines funktionstüchtigen Organismus übersetzt wird.
Eine ausführliche Definition dieses Fachgebietes der Biologie ist hier einsehbar:
http://www.spektrum.de/lexikon/biologie/entwicklungsgenetik/21599
Zwei Beispiele für aktuelle Forschung:
Am Max-Planck-Institut für Molekulare Genetik wird an verschiedenen Fragestellungen zur Entwicklungsgenetik geforscht.
https://www.molgen.mpg.de/de/Entwicklungsgenetik und https://www.molgen.mpg.de/23577/Groups
Und auch das Helmholtz-Zentrum für Entwicklungsgenetik in München hat verschiedenste Forschungsthemen:
https://www.helmholtz-muenchen.de/idg/institute/about-us/goals/index.html
Bei beiden Instituten findet man Publikationslisten mit den Ergebnissen der Forschungsprojekte.
Als deutschsprachige Literaturempfehlung aus dem Lehrbuchbereich wäre das Kapitel „Entwicklungsgenetik“ im Genetik-Buch von J. Graw zu nennen:
- Graw J. (2010) Entwicklungsgenetik. In: Genetik. Springer-Lehrbuch. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-04999-6_11 oder ISBN 978-3-642-04998-9
4. Stammzellenforschung – Bauplan für den künstlichen Menschen?
Artikel aus der Süddeutschen Zeitung (2013) zu dem als Durchbruch in der Stammzellenforschung gefeierten Experiment, bei dem erstmals menschliche Embryonen geklont und Stammzellen aus ihnen gewonnen wurden:
Ausführliche Beschreibungen und Erklärungen der Stammzellenforschung stellt das Kompetenznetzwerk Stammzellenforschung NRW zur Verfügung:
http://www.stammzellen.nrw.de/ueber-stammzellen.html
http://www.stammzellen.nrw.de/ueber-stammzellen/videos.html
Auch das Spektrum-Lexikon gibt eine sehr gute Definition:
http://www.spektrum.de/lexikon/biologie/stammzellen/63289
Wo liegen die ethischen Hauptprobleme der Stammzellenforschung?
Ein Einstieg in die Diskussion bietet eine kurze Zusammenstellung hier:
http://www.wissensschau.de/stammzellen/stammzellen_ethik.php
Die Deutsche Forschungsgemeinschaft (DFG, www.dfg.de), welche Fördergelder zu Forschungszwecken vergibt, hat eine Stellungnahme veröffentlicht zum Thema „Problemkreis humane embryonale Stammzellen“. Die Stellungnahme enthält unter Kapitel II auch eine ethische und rechtliche Beurteilung der spezifischen Forschung.
http://www.dfg.de/download/pdf/dfg_im_profil/reden_stellungnahmen/archiv_download/eszell_d_99.pdf
Das Deutsche Referenzzentrum für Ethik in den Biowissenschaften stellt zum Thema „Stammzellenforschung“ ebenfalls aktuelle sachliche, fachliche Informationen zur Verfügung – und widmet auch den ethischen Problemstellungen einen Raum:
http://www.drze.de/im-blickpunkt/stammzellen
Die internationale, europäische und deutsche Gesetzeslage
Auf der weiterführenden Seite zu diesem Text wird auch die internationale, europäische und deutsche Gesetzeslage erörtert:
http://www.drze.de/im-blickpunkt/stammzellen/gesetze-und-regelungen
Hier können Lehr- und Lernmaterialien bei „Diskurslernen.de“ heruntergeladen werden. Dies ist ein Angebot des DRZE (s.o.).
http://www.diskurslernen.de/humane_embryonale_stammzellen/
Die Internationale Gesellschaft für Stammzellenforschung (ISSCR, http://www.isscr.org) beschreibt sich selbst wie folgt:
„The International Society for Stem Cell Research is an independent, nonprofit organization established to promote and foster the exchange and dissemination of information and ideas relating to stem cells, to encourage the general field of research involving stem cells, and to promote professional and public education in all areas of stem cell research and application.“
Sie hält umfangreiche Infoseiten in englischer Sprache bereit:
http://www.closerlookatstemcells.org
5. Embryonenforschung, Embryonenschutzgesetz
Epigenetik und Embryonenforschung
Reprogrammierung (Aktive Demethylierung des väterlichen Genoms und passive Demethylierung des mütterlichen Genoms in der befruchteten Eizelle)
Haaf, T (2005). Epigenetische Genomreprogrammierung im frühen Säugerembryo:
Mechanismen und Pathologie. medgen 17: 275-279. (https://www.medgenetik.de/2005/2005_3_275_haaf.pdf)
Haaf, T (2006). Epigenetische Genomreprogrammierung in der Keimbahn und im frühen Embryo: Implikationen für die Reproduktionsmedizin. J Reproduktionsmed Endokrinol 3 (3): 136-140. (http://www.kup.at/kup/pdf/5889.pdf)
Embryonenschutzgesetz
Informationen zum Embryonenschutzgesetz und Stammzellengesetz findet man bei der Bundeszentrale für Politische Bildung:
http://www.bpb.de/gesellschaft/umwelt/bioethik/33770/embryonenschutz
Das Deutsche Referenzzentrum für Ethik in den Biowissenschaften gibt ebenfalls einen Überblick und eine Erläuterung der Rechtslage (auch mit Absätzen über die Rechtslage in anderen europäischen Ländern):
http://www.drze.de/im-blickpunkt/pid/rechtliche-aspekte
Das Gesetz selbst findet man hier: http://www.gesetze-im-internet.de/eschg/index.html
Eine Ergänzung zum Embryonenschutzgesetz mit Änderungen für den Bereich der Präimplantationsdiagnostik findet man hier: http://www.bundesgerichtshof.de/SharedDocs/Downloads/DE/Bibliothek/Gesetzesmaterialien/17_wp/PID/bgbl.pdf;jsessionid=5728946442255D978A0A2E4DFE058F3F.1_cid286?__blob=publicationFile
Ein Artikel der Theologin Sibylle Wolf im Deutschen Ärzteblatt vergleicht die in Deutschland und Großbritannien unterschiedliche Regelung der Zulassung der Forschung an humanen embryonalen Stammzellen. Vor allem bezogen auf den Menschenwürde-Begriff ergeben sich tiefgreifende Unterschiede:
https://www.aerzteblatt.de/archiv/68068/Embryonenforschung-Ueber-den-Umgang-mit-menschlichem-Leben
6. Reproduktionsmedizin – Fortpflanzung und Kinderwunsch
Die Reproduktionsmedizin setzt dann an, wenn Störungen bei der natürlichen Fortpflanzung auftreten. Sie beschäftigt sich mit der natürlichen und assistierten Fortpflanzung, den Grundlagen und der Kontrolle der menschlichen Zeugungsfähigkeit und ihrer Störungen. Sie ist ein interdisziplinäres Fachgebiet der Medizin.
Mitte Februar 2017 fand in Berlin eine Messe mit dem Titel „Kinderwunsch-Tage“ statt. Möglichkeiten wurden vorstellt, wie ein Kinderwunsch, der nicht auf natürlichem Wege erfüllt werden kann, mit künstlichen Mitteln umgesetzt werden kann. Nicht alle der dort vorgestellten Methoden sind in Deutschland gesetzlich erlaubt.
Die Geschichte der Reproduktionsmedizin
Die Geschichte der Reproduktionsmedizin wird auf den Seiten der Deutschen Gesellschaft für Reproduktionsmedizin erläutert:
http://www.repromedizin.de/ueber-die-dgrm/geschichte.html
7. Präimplantationsdiagnostik
Die Präimplantationsdiagnostik (PID) umfasst alle Methoden zellbiologischer und molekulargenetischer Untersuchungen, die der Entscheidung dienen, ob ein durch In-vitro-Fertilisation (IVF) erzeugter Embryo in die Gebärmutter eingepflanzt wird oder nicht.
Die PID wurde seit Anfang der 1990er Jahre weltweit bei mehr als 10.000 Zeugungen von Kindern angewendet.
Das Thema PID wurde bereits in Sendung 02 behandelt. Dort finden Sie auch Zusatzmaterialien zu diesem Thema.
8. Keimbahntherapie – Für und Wider eines medizinischen Meilensteins
Ende 2015: Man weiss, man könnte (bald), aber man tut es nicht – die Anwendung der Keimbahnintervention in menschlichen Zellen. Die Keimbahntherapie ist ein Verfahren, um vererbte Krankheiten, die auf einem Gendefekt beruhen, bei Nachkommen eines Trägers des defekten Gens zu heilen bzw. die Vererbung dieses Gendefekts zu verhindern.
Dieses Verfahren ist medizinisch und technisch möglich, aber es ist ein Tabu und wurde bisher noch nicht am Menschen realisiert.
Hierzu ein Artikel von Johann Grolle im Spiegel:
Umstrittene Experimente in US-Labors
2017: US-amerikanische Forscher haben menschliche Embryonen von einem Gendefekt befreit – ein sehr umstrittenes Experiment im Labor. Die Genschere CRISPR erlaubt solche Eingriffe und hat das theoretische Potential, sich abzeichnende Erbkrankheiten durch genchirurgische Eingriffe zu korrigieren. Für die Medizin ein großer Erfolg und Meilenstein. Gleichzeitig ein schwieriger Fall für die Forschungsethik:
In einem Artikel in der Ärztezeitung wird davon ausgegangen, dass die Anwendung der Keimbahntherapie nur noch eine Frage der Zeit ist:
Die ethische Debatte zur Gen-Editierung bei Embryos in den Reihen der Wissenschaft
- http://www.deutschlandfunk.de/gentechnik-am-embryo-crispr-cas-technik-entfacht-ethische.676.de.html?dram:article_id=331352
- http://www.nature.com/news/embryo-editing-sparks-epic-debate-1.17421
Ein Überblick zum Thema auf der Seite des Instituts Technik-Theologie-Naturwissenschaften an der Ludwig-Maximilians-Universität München:
http://www.ttn-institut.de/node/179
Leopoldina-Präsident Jörg Hacker in der FAZ, 17.5.2016: „Der Grund des Lebens“ – wissenschaftliche Erkenntnisentwicklung und für und wider die Eingriffe in die menschliche Keimbahn (=Keimbahnintervention)
Der Deutsche Ethikrat hat auf seiner Jahrestagung über das Thema diskutiert:
http://www.ethikrat.org/dateien/pdf/jahrestagung-22-06-2016-dabrock.pdf
Gesetzeslage zur Keimbahntherapie
- http://www.theeuropean.de/jochen-taupitz/6816-embryonenschutzgesetz-und-keimbahntherapie
- http://www.gentechnologiebericht.de/gen/bilder/zentrale%20Texte_Gentherapie.pdf
- https://meddb.mpicc.de/show_all.php
9. Sichelzellenanämie – Warum bietet die Blutkrankheit Schutz vor Malaria?
Die Sichelzellanämie ist eine Erbkrankheit der roten Blutkörperchen (Erythrozyten) und gehört zu den hämolytischen Anämien (Blutarmut) bzw. Hämoglobinopathien. Die Sichelzellanämie wird durch eine Punktmutation auf Chromosom 11 ausgelöst und autosomal-rezessiv vererbt. Diese Punktmutation führt dazu, dass in der 6. Aminosäurenposition der β-Globinkette die Aminosäure Glutamat gegen Valin ausgetauscht wird.
Bei homozygoten Trägern, bei denen sowohl das mütterliche als auch das väterliche Gen mutiert ist, sind alle β-Globinketten von dem Austausch betroffen. Homozygote Träger bilden nur das irreguläre Hämoglobin (Sichelzellhämoglobin) und leiden unter der Sichelzellkrankheit.
Heterozygote Menschen hingegen tragen nur ein krankes Gen und bilden gleichermaßen sowohl das Sichelzellhämoglobin als auch das normale Hämoglobin. Sie haben weitgehend keine Symptome und genießen zudem einen Schutz vor Malaria.
Das Sichelzellhämoglobin verursacht die Sichelform der roten Blutkörperchen. Gesunde Erythrozyten sind rund, glatt, elastisch und können sich gut im Blutstrom bewegen. Sichelzellen hingegen sind spitz und lang, und haben nicht mehr diese Elastizität und Beweglichkeit. Sie zerfallen leichter als normale Erythrozyten, bilden Aggregate und verstopfen Blutgefäße.
Überblick über die Krankheit:
https://www.youtube.com/watch?v=1ql-X60CUNQ
https://www.lifeline.de/krankheiten/sichelzellanaemie-id21222.html
Sichelzellanämie und Schutz vor Malaria:
- Pamplona, A et al. (2007). Heme oxygenase-1 and carbon monoxide suppress the pathogenesis of experimental cerebral malaria. Nat Med 13 (6): 703-710. (https://doi.org/10.1038/nm1586)
- Ferreira, A et al. (2011). Sickle Hemoglobin Confers Tolerance to Plasmodium Infection. Cell 145 (3): 398-340. (https://doi.org/10.1016/j.cell.2011.03.049)
- Hasse, S (2011). Warum Sichelzellenanämie vor Malaria schützt – Mechanismus aufgeklärt. Pressemitteilung 115/2011 vom 02.05.2011, Universität Leipzig. (https://www.uni-leipzig.de/service/kommunikation/medienredaktion/nachrichten.html?ifab_modus=detail&ifab_id=4104)
Therapieansätze mithilfe der CRISPR-Methode:
- Ledford, H (2016). CRISPR deployed to combat sickle-cell anaemia. Nature News. (https://doi.org/10.1038/nature.2016.20782)
- DeWitt, MA et al. (2016). Selection-free Genome Editing of the Sickle Mutation in Human Adult Hematopoietic Stem/Progenitor Cells. Sci Transl Med 8 (360): 360ra134. (https://doi.org/10.1126/scitranslmed.aaf9336)
10. HIV-Resistenz – Wieso sind manche Menschen immun?
Das HI-Virus (Human Immunodeficiency Virus) gehört zur Familie Retroviridae (Retroviren). Es handelt sich um behüllte Viren mit einzelsträngigem RNA-Genom ((+)ssRNA), die zur Vermehrung in der Wirtszelle eine doppelsträngige DNA als Zwischenprodukt bilden. Sie bringen ein Enzym mit, das den üblichen genetischen Informationsfluss (DNA → RNA → Protein) umkehrt.
Die reverse Transkriptase ist in der Lage, die virale RNA in doppelsträngige DNA umzuschreiben, eine Fähigkeit, die sich in der Bezeichnung „Retroviren“ – Reverse Transkriptase Onkoviren – widerspiegelt.
Die Controller besitzen eine natürliche Immunität
Nur einer von 300 HIV-Infizierten besitzt eine natürliche Immunität gegen den Erreger. Diese Menschen, die als „Controller“ bezeichnet werden, benötigen keine antiretrovirale Therapie, da ihr Körper die Ausbreitung des Virus selbst unterdrücken kann:
https://www.pharmazeutische-zeitung.de/index.php?id=35886
Struktur des HI-Virus:
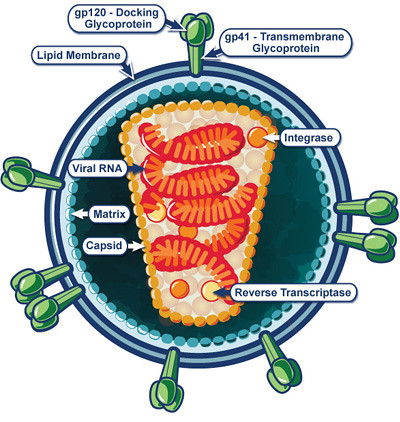
https://c1.staticflickr.com/5/4061/5080768345_18f4b256d1.jpg
Vermehrungszyklus des HI-Virus:

https://c1.staticflickr.com/5/4126/5057022555_cabcf6d00a_b.jpg
HIV und AIDS: Überblick über die Zeichen, Symptome, Übertragung, Ursachen und Pathologie
Therapie:
11. Mitochondrienspende – Ein Baby, drei Eltern
Mitochondrien sind Zellorganellen, die für die Produktion von Energie (in Form von ATP (Adenosintriphosphat)) zuständig sind und deswegen auch als „Kraftwerke der Zellen“ bezeichnet werden. Sie besitzen ein eigenes mitochondriales Genom (mtDNA) und teilen sich unabhängig von ihrer Mutterzelle (was im Übrigen für die Endosymbiontentheorie spricht).
Mitochondrien werden maternal vererbt, d.h. der Mensch erhält alle seine Mitochondrien von der Mutter – Mutationen der mtDNA eingeschlossen. Frauen mit einer mitochondrialen Erkrankung (Mitochondropathie) geben diese notwendigerweise an die Kinder weiter.
Die Mitochondrial Replacement Therapy (MRT) ermöglicht im Rahmen einer künstlichen Befruchtung (In-vitro-Fertilisation, IVF) den Austausch defekter Mitochondrien der Eizelle der Mutter durch intakte Mitochondrien einer Spenderfrau. Daher wird die Therapie auch als Three Parent IVF oder Mitochondrienspende bezeichnet.
Es gibt drei Verfahren der sogenannten Mitochondrienspende:
- Spindeltransfer ((Maternal) Spindle Transfer, ST);
- Vorkerntransfer (Pronuclear Transfer, PNT) und
- Polkörpertransfer (Polar Body Transfer, PBT), vgl. dazu Wolf, DP/ Mitalipov, N/ Mitalipov, S (2015).
Mitochondrial replacement therapy in reproductive medicine. Trends Mol Med 21 (2): 68-76 (https://doi.org/10.1016/j.molmed.2014.12.001) sowie Greenfield, A et al. (2017). Assisted reproductive technologies to prevent human mitochondrial disease transmission. Nat Biotechnol 35 (11): 1059-1068 (https://doi.org/10.1038/nbt.3997).
http://www.wissensschau.de/reproduktionsmedizin/mitochondrien_spende_kuenstliche_befruchtung.php
Die Mitochondrienspende ist allerdings nicht ganz unumstritten, denn die mütterlichen Mitochondrien werden nicht vollständig entfernt. Eine kleine Zahl fehlerhafter Mitochondrien gelangt stets in die neue Eizelle und neuere Studien besagen, dass diese sich im Laufe der Zeit vermehren und die Mitochondropathie sich nicht aufhalten lässt. Eine Heilung der Krankheit wäre somit ausgeschlossen. Nur der Ausbruch der Mitochondropathie würde sich zeitlich nach hinten verschieben.
- Darnovsky, M (2013). A slippery slope to human germline modification. Nature 499 (7457): 127. (https://doi.org/10.1038/499127a)
- Yamada, M et al. (2016). Genetic Drift Can Compromise Mitochondrial Replacement by Nuclear Transfer in Human Oocytes. Cell Stem Cell 18 (6): 749-754. (https://doi.org/10.1016/j.stem.2016.04.001)
- Hyslop, LA et al. (2016). Towards clinical application of pronuclear transfer to prevent mitochondrial DNA disease. Nature 534 (7607): 383-386. (https://doi.org/10.1038/nature18303)
Weiterführende Literatur/ Ethische Beurteilung der Mitochondrienspende
- Schlütter, J (2013). Gentherapie: Briten wollen Drei-Eltern-Baby. Tagesspiegel Online (http://www.tagesspiegel.de/wissen/gentherapie-briten-wollen-drei-eltern-baby/7960670.html)
- Schooltink, H (2013). Mitochondriale Erkrankungen. Fehler in den Kraftwerken der Zelle. Pharmazeutische Zeitung online (https://www.pharmazeutische-zeitung.de/index.php?id=46982)
- SPIEGEL ONLINE (2014). Umstrittene Befruchtungsmethode. Ein Kind, drei Eltern. (http://www.spiegel.de/wissenschaft/medizin/1-kind-von-3-eltern-fda-zu-fortpflanzung-und-umstrittener-befruchtung-a-955727.html)
- Süddeutsche Zeitung Online (2016). Baby mit drei biologischen Eltern geboren. (http://www.sueddeutsche.de/gesundheit/reproduktionsmedizin-zwei-muetter-ein-vater-1.3182397)
- Dimond, R (2015). Social and ethical issues in mitochondrial donation. Br Med Bull 115 (1): 173-182. (https://doi.org/10.1093/bmb/ldv037)
- Dimond, R & Stephens, N (2017). Three persons, three genetic contributors, three parents: Mitochondrial donation, genetic parenting and the immutable grammar of the ‘three x x’. Health (London) 1-19, doi: 10.1177/1363459316689380 (http://journals.sagepub.com/doi/pdf/10.1177/1363459316689380)
- Liao, SM (2017). Do Mitochondrial Replacement Techniques Affect Qualitative or Numerical Identity? Bioethics 31 (1): 20-26. (http://onlinelibrary.wiley.com/doi/10.1111/bioe.12308/epdf)
- Palacios‑González, C (2017). Are there moral differences between maternal spindle transfer and pronuclear transfer? Med Health Care and Philos 20 (4): 503-511. (https://link.springer.com/content/pdf/10.1007%2Fs11019-017-9772-3.pdf)
- Palacios‑González, C (2017). Ethics of Mitochondrial Replacement Techniques: A Habermasian Perspective. Bioethics 31 (1): 27-36. (http://onlinelibrary.wiley.com/doi/10.1111/bioe.12307/epdf)
- Scully, JL (2017). A Mitochondrial Story: Mitochondrial Replacement, Identity and Narrative. Bioethics 31 (1): 37-45. (http://onlinelibrary.wiley.com/doi/10.1111/bioe.12310/epdf)
- Zhang, J et al. (2017). Live birth derived from oocyte spindle transfer to prevent mitochondrial disease. Reprod Biomed Online 34 (4): 361-368. (https://doi.org/10.1016/j.rbmo.2017.01.013)
Zusatzmaterialien als PDF zum Herunterladen
Die Materialien wurden zum Zugriffszeitpunkt 24.11.2017 erstellt von:
Volker Mosbrugger, Sybille Roller, Francesco Lupusella, Annette Klussmann-Kolb, Rebecca Spitzenberger
