Autor: Michael Lange
Die Crispr-Revolution: genetisch veränderte Tiere
Eine Biologin und eine Biochemikerin wollten wissen, wie sich Bakterien gegen Viren schützen. Bei ihrer Grundlagenforschung entdeckten sie ein Werkzeug, das die Gentechnik innerhalb von fünf Jahren revolutioniert hat: CRISPR/Cas. Damit lassen sich schnell und gezielt einzelne Gene ausschalten oder verändern.
Kann die Genschere Malaria ausrotten?
Heute ist die Genschere CRISPR/Cas aus den Laboren der Welt nicht mehr wegzudenken. Mit ihrer Hilfe entwickeln Wissenschaftler neue Konzepte für die Gentherapie, sie züchten Tierorgane, die sich als Transplantate für Menschen eignen sollen, versuchen ausgestorbene Tierarten wie das Mammut wieder zum Leben zu erwecken, indem sie Elefanten genetisch umbauen – und denken darüber nach, wie sie tief in die Evolution eingreifen können.
So möchten sie zum Beispiel Malaria durch eine genetische Kettenreaktion ausrotten. Ob das alles funktioniert wie geplant, ist keinesfalls sicher. CRISPR/Cas hat die Arbeit der Gentechniker von Grund auf verändert. In Zukunft wird sie auch die Ökologie beeinflussen – mit neuen Möglichkeiten und neuen Risiken.
Sendung als Podcast
Download Funkkolleg Biologie und Ethik (03), MP3-Audioformat, 24:36 Min., 45.0 MB
Sendung in hr-iNFO: 11.11.2017, 11:30 Uhr
Zusatzmaterial
- CRISPR/Cas9
- Genome Editing / Genomchirurgie
- RNA / DNA
- Charpentier, Doudna et al.
- Sicherheitsbestimmungen Genlabore
- Anwendung CRISPR/Cas-Verfahren bei Tieren
- Ethische Diskussion: Gentechnik bei Tieren
- Xenotransplantation
- Wollhaarmammut
- Gene Drive
- Gesetzlicher Rahmen
- Bekämpfung von Mückenarten mittels Gene Drive
Veranstaltungstipp
6. Dezember 2017 | 19 Uhr | Bundeskunsthalle Bonn
SCIENCE ON – Talk mit Cécile Schortmann: „Genome Editing – Wird das Leben neu buchstabiert?“
1. CRISPR/Cas9: Wie funktioniert die Genschere?
Eine kurze Erklärung dieses oft als „Genschere“ bezeichneten gentechnischen Verfahrens gab es bereits in den Zusatzmaterialien zu Sendung 1 des Funkkollegs
Eine Sendung aus der Reihe „Lesch’s Kosmos“ mit dem Titel „CRISPR-Cas9: die neue Gen-Revolution“ ist in der ZDF-Mediathek verfügbar:
https://www.zdf.de/wissen/leschs-kosmos/videos/was-ist-crispr-102.html
Die internationale Fachzeitschrift NATURE (http://www.nature.com/nature/index.html) hat dem Thema CRISPR im Jahr 2016 eine Sonderausgabe gewidmet (http://www.nature.com/news/crispr-1.17547). Für den Kurzeinstieg vorweg ein Artikel, der laut seines Titels die 7 Fakten enthält, die jede/r über CRISPR wissen sollte:
http://www.nature.com/news/genome-editing-7-facts-about-a-revolutionary-technology-1.18869
Wie lässt sich die neue Technologie nutzen?
Folgende englischsprachige Nature-Artikel befassen sich auch mit den breiten Anwendungsmöglichkeiten der Technologie zur genetischen Entschlüsselung und Veränderung von Organismen.
http://www.nature.com/news/welcome-to-the-crispr-zoo-1.19537
https://www.nature.com/news/crispr-gene-editing-is-just-the-beginning-1.19510
Ebenfalls kann bei Nature ein Lehrposter heruntergeladen werden, welches die Mechanismen der Funktionsweise der CRISPR-Cas-Technologie illustriert.
https://www.nature.com/nrmicro/posters/crispr/posters.pdf
Eine Übersicht unlängst zu CRISPR/Cas9 erschienener Artikel bietet eine umfassende online-Themenseite der ZEIT. Dort erklärt auch ein anschauliches kurzes Video (~3 min), wie das neue Universalwerkzeug der Gentechnik funktioniert:
http://www.zeit.de/thema/crispr
Ein aktueller Übersichtsartikel mit Antworten auf fünf häufige Fragen zu CRISPR/Cas9 ist online bei Spektrum der Wissenschaft einsehbar:
http://www.spektrum.de/wissen/wie-funktioniert-crispr-cas9/1441060
Aus der Reihe Spektrum Wissenschaft Kompakt ist ein Sonderband „CRISPR-Cas9 – Erbgut auf dem Schneidetisch“ erschienen. Die empfehlenswerte Veröffentlichung ist als Print oder als Digital-Ausgabe erhältlich.
Ähnlichen Inhalt zeigt auch die Informationsseite des Forums Bio- und Gentechnologie e. V. zum Thema Gentechnik bei Tieren:
http://www.transgen.de/tiere/670.gentechnik-tieren-stand.html
Und, ganz aktuell, ein Artikel über zwei neu entwickelte Verfeinerungen der Technik der „Genschere“, die beide am 15. 10. 2017 parallel in Science bzw. Nature veröffentlicht und hier zusammengefasst wurden – der Autor bezeichnet sie als „ethisch minimalinvasiv“:
http://www.spektrum.de/news/groesste-probleme-von-crispr-cas9-geloest/1514381
2. Genome Editing/Genomchirurgie: rote, grüne und weiße Gentechnik?
Genome Editing wird die molekularbiologische Methode genannt, mit der zielgerichtete Veränderungen von DNA durchgeführt werden können. Verschiedene Enzyme, genauer: synthetisch hergestellte Nukleasen, können eingesetzt werden, um die DNA-Stränge an bestimmten Stellen zu zerschneiden. Die Cas9-Nuklease ist eine davon.
Werden gezielte DNA-Veränderungen bei Mikro-Organismen durchgeführt, spricht man von „weißer Gentechnik“, bei Pflanzen von „grüner Gentechnik“ und bei Tieren von „roter Gentechnik“. Wird die Technologie bei Menschen angewandt, wird sie als Gentherapie bezeichnet.
Auf den Themenseiten „Synthetische Biologie“ der Max-Planck-Gesellschaft wird das Genome Editing mittels Designer-Nukleasen wie folgt beschrieben:
Neue Werkzeuge für Genom-Ingenieure
„Zu den Fortschritten in der Fertigung von Erbmaterial gesellen sich neue Werkzeuge: Mit den sogenannten Designer-Nukleasen ist zum Beispiel eine neue Generation molekularer Präzisionsinstrumente entwickelt worden, die nun recht einfach und gezielt Veränderungen von Genomen in lebenden Zellen ermöglichen. Designer-Nukleasen sind Genscheren, die sich auf einen bestimmten Zielort im Genom programmieren lassen. An definierten Stellen im Genom setzen die Genscheren ihre Schnitte.
Sie erzeugen Doppelstrangbrüche und setzen so die Auto-Reparaturmechanismen der Zelle in Gang. Auf diese Weise lassen sich an vielen Stellen gleichzeitig Mutationen in das Erbgut einfügen, Abschnitte herausschneiden oder DNA-Fragmente einbauen. Molekularbiologen sprechen hierbei vom Genome Editing. Besonders ein Designer-Nuklease-System namens CRISPR-Cas9 hat wegen seiner einfachen Handhabung rasant Einzug in die Labore der Biotechnologen gehalten.“
Der gesamte Artikel befindet sich hier: https://www.synthetische-biologie.mpg.de/6491/dna-und-genom-herstellen
3. RNA / DNA: Was ist der Unterschied?
Kurz und anschaulich erklärt sind Desoxyribonukleinsäure (DNA) und Ribonukleinsäure (RNA) und deren Aufgaben in einem Videoclip der Zeitschrift Focus:
Eine gute Übersicht über die Eigenschaften und Unterschiede von RNA und DNA bietet die medizinische Wissensplattform AMBOSS:
https://amboss.miamed.de/wissen/Aufbau_von_DNA_und_RNA
Ausführlicher findet man das Basiswissen zu DNA und RNA in Fachbüchern zur Biologie und z.B. in einer zusammenfassenden Foliensammlung aus einer Mitarbeiterschulung an der Medizinischen Fakultät der Ruhr-Universität Bochum:
https://www.ruhr-uni-bochum.de/genetik/Unterlagen/Aufbau%20und%20Struktur%20von%20DNA.pdf
4. Die Entdeckerinnen der Genschere: Emmanuelle Charpentier und Jennifer Doudna
Die beiden Wissenschaftlerinnen Emmanuelle Charpentier und Jennifer Doudna haben im Jahr 2012 ihre neue, gemeinsam entdeckte und entwickelte Methode CRISPR/Cas veröffentlicht.
Ein differenziertes Porträt der Wissenschaftlerin Emmanuelle Charpentier, heute Direktorin des Max-Planck-Institutes für Infektionsbiologie, und ihrer Forschungsthemen findet sich hier: http://www.mpiib-berlin.mpg.de/1721904/news_publication_10755929
Jennifer Doudna leitet heute das Biochemische Labor an der Universität Berkeley, welches ihren Namen trägt. Was dort an Forschungsarbeit zur noch jungen Methode CRISPR/Cas geleistet wird, ist auf der Webseite des Doudna-Labors einzusehen: http://rna.berkeley.edu/crispr.html
Die beiden Wissenschaftlerinnen erläutern aus ihrer Sicht in einem Review-Paper (in englischer Sprache) aus dem Jahr 2014 die Entwicklung der letzten Jahre (http://genetics.wustl.edu/bio5491/files/2016/01/Doudna-and-Charpentier.pdf).
Sehr anschaulich wird in ihrer Abbildung 1 deutlich, wie sich die zwei Zweige der CRISPR- und der Genome Editing-Forschung im Jahr 2012 durch die Entdeckung trafen, dass Cas9 eine „RNA-programmierbare“ DNA-Endonuklease ist.
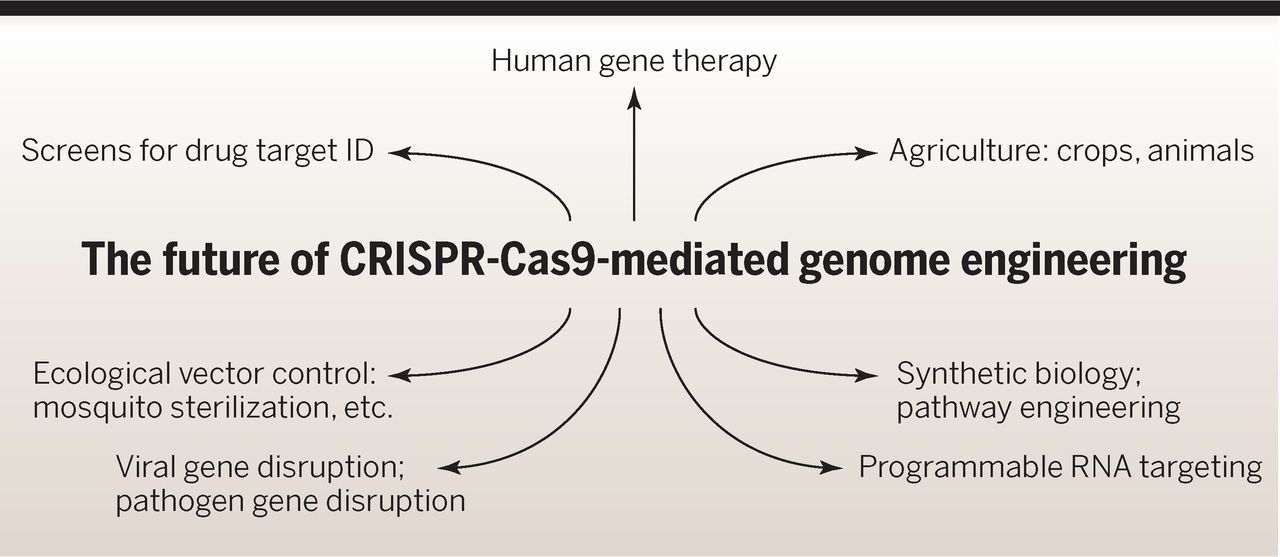
Sie zeigen auf, welche Zelltypen und Organismen bisher durch die CRISPR-Technologie bearbeitet wurden und welche zukünftigen Möglichkeiten im medizinischen und agrokulturellen Bereich sich aus der Methode ergeben können.
Hier sind auch besonders interessant: Abbildungen 5 und 6, letztere zeigt die praktischen Anwendungsmöglichkeiten der Technik. Hier auch genannt sind die Anwendungen in der Landwirtschaft bei Pflanzen und Tieren.
5. Welche Sicherheitsbestimmungen gelten in den Genlaboren?
Wie bereits in den Zusatzmaterialien zu Sendung 2 genannt, gelten klare Bestimmungen, wie ein Labor ausgestattet sein muss, wenn darin gentechnische Arbeiten vorgenommen werden. Es gibt mehrere biologische Sicherheitsstufen, die entsprechende Sicherheitsmaßnahmen erfordern.
Die zentrale Kommission für die biologische Sicherheit hält die deutsche Genteschnik-Sicherheitsverordnung als PDF-Download bereit.
Eine wichtige Rolle bei der Sicherung der Umwelt und des Menschen vor Schäden durch gentechnisch veränderten Organismen nimmt auch das Deutsche Biosafety-Clearing-House ein:
https://biosicherheit-bch.de/BCH/DE/Aufgaben/aufgaben_node.html
6. Anwendung CRISPR/Cas-Verfahren bei Tieren
Das Bundesamt für Naturschutz (BfN) fasst Funktionsweise und Anwendungsbereiche von CRISPR-Cas hier kurz zusammen:
https://www.bfn.de/27364.html
Naturschutz und Wirkungen auf die Umwelt
Hintergründe und Empfehlungen aus der Sicht des Naturschutzes zum Umgang mit der neuen Methode finden sich hier:
https://www.bfn.de/fileadmin/BfN/agrogentechnik/Dokumente/17-07-13_Hintergrundpapier_Neue_Techniken_end_online_barrierefrei.pdf
Dabei wird empfohlen, mögliche Umweltwirkungen frühzeitig zu dokumentieren und die Anwendung entsprechend dem Vorsorgeprinzip zu regulieren – wobei betont wird, dass „Regulierung hier als Chance zu verstehen [ist] und nicht als Verhinderung“ von Forschung und Entwicklung der neuen Techniken.
In den USA bereits erhältlich: genetisch veränderter Lachs
Mit der Entwicklung des CRISPR-Cas-Verfahrens hat weltweit die Gen-Forschung an Nutztieren zugenommen. Verschiedene – fast ausschließlich wirtschaftlich motivierte – Ansätze werden verfolgt: die Tiere sollen resistenter gegen Krankheitserreger gemacht werden oder sie sollen durch einen erhöhten Fleischanteil bzw. eine gesteigerte Milch- oder Wollproduktion „ertragreicher“ werden. Diese genetisch veränderten Tiere sind noch nicht an den Verbraucher gelangt – bis auf eine Ausnahme: in den USA seit 2015 im Handel zugelassener Lachs.
http://www.transgen.de/tiere/670.gentechnik-tieren-stand.html
http://www.transgen.de/aktuell/2528.usa-zulassung-gentechnik-lachs.html
Aber nicht nur die Nutztiere im engeren Sinne sind von den Entwicklungen betroffen – auch Haustiere werden inzwischen gezielt mittels der CRISPR/Cas-Technologie verändert. Und wer würde etwas dagegen haben, wenn mittels Genveränderungen die Moskito-Arten, die schwere Krankheiten übertragen können, dezimiert würden? Ein Artikel über die Möglichkeiten und Anwendungsbereiche von Genome Editing bei Tieren mittels CRISPR/Cas:
http://www.spektrum.de/news/was-koennen-wir-von-crispr-erwarten/1408668
7. Ethische Diskussion: Gentechnik bei Tieren
Das Bundesinstitut für Risikobewertung (BfR) hat kürzlich eine Studie zur Vorbehalten, Informationsbedürfnis und Risikowahrnehmung der Bevölkerung durchgeführt, die zeigt, dass die Befragten Genome Editing zwar kaum kannten und wenig über diese Techniken wussten, den Einsatz dieser Verfahren z.B. im Lebensmittelbereich aber mehrheitlich ablehnten.
Die vollständigen Ergebnisse stehen hier zur Verfügung:
Warum lehnen wir Gentechnik intuitiv ab?
„Warum lehnen wir Gentechnik intuitiv ab?“ fragte sich der Philosoph Stefaan Blancke und erläutert seine Recherche in einem kurzen Artikel:
http://www.geo.de/natur/nachhaltigkeit/425-rtkl-psychologie-warum-wir-intuitiv-gegen-gentechnik-sind
Blinde Legehennen – nur ein Gedankenexperiment?
Ein philosophisches Gedankenexperiment, in dem es um Züchtung blinder Legehennen geht, zeigt auf, dass tierethisch „richtige“ Entscheidungen nicht unbedingt immer einfach zu treffen sind.
http://www.geo.de/natur/tierwelt/7352-rtkl-gentechnik-die-blinde-moral
Der deutsche Ethikrat hat das Thema selbstverständlich auch aufgegriffen und eine Adhoc-Empfehlung ausgesprochen. Diese enthält jedoch mehr Bezug auf Eingriffe in die menschliche Keimbahn, denn zu Genveränderungen bei Tieren. Trotzdem sei dieses Papier hier genannt:
http://www.ethikrat.org/themen/forschung-und-technik/genomforschung-genomeditierung
Welche ethischen Fragen gilt es beim Klonen von Tieren zu beachten?
Bei einer Veranstaltung im Jahr 2009 (vor der Entwicklung von CRISPR) hat das Forum Bioethik des Ethikrats bereits über die Tierklonierung beraten – und folgende zentrale Fragestellungen in seine Diskussion aufgenommen:
- Hat das Klonen Leiden für die betroffenen Tiere zur Folge?
- Welche Fragen ergeben sich im Hinblick auf den Erhalt der Artenvielfalt von Nutztieren?
- Sind durch das Klonen gegenüber dem bisherigen Umgang mit Tieren bestehende ethische Grenzen betroffen oder überschritten?
- Ergeben sich durch das Klonen besondere Fragen hinsichtlich der Patentierung und wirtschaftlichen Verwertung von Tieren und der Kennzeichnungspflicht bei der Vermarktung von Waren, die auf geklonte Tiere zurückzuführen sind?
Die Vortragsmitschriften und Audioprotokolle der Veranstaltung findet man auf der Veranstaltungsseite: http://www.ethikrat.org/veranstaltungen/forum-bioethik/klone_im_Stall
Das Deutsche Referenzzentrum für Ethik in den Biowissenschaften führt in einem allgemeinen Text mit Abwägungen zum Einsatz von Gentechnik im speziellen Fall des Eingriffes bei Tieren auch die „Schutzpflichten“ dem Lebewesen gegenüber an:
http://www.drze.de/im-blickpunkt/gmf/ethische-aspekte
Und ganz grundlegend betrachtet: wie sind die moralischen Grenzen unseres Verhaltens gegenüber Tieren überhaupt begründet und bemessen? In einem Essay auf den Seiten der Bundeszentrale für Politische Bildung sind Tierethische Positionen erläutert.
Die Autoren erwähnen, dass Tierschutz in Deutschland und in der Schweiz in der Verfassung verankert ist. So lautet es im Deutschen Tierschutzgesetz §1: „Zweck dieses Gesetzes ist es, aus der Verantwortung des Menschen für das Tier als Mitgeschöpf dessen Leben und Wohlbefinden zu schützen.“ (das gesamte Gesetz siehe hier: http://www.gesetze-im-internet.de/tierschg/BJNR012770972.html). Also wird Bezug genommen auf die oben erwähnten Schutzpflichten. Gleichzeitig räumt sich der Mensch jedoch Nutzungsrechte ein – darum ja auch der Begriff „Nutztiere“. Dies führt zwangsläufig zu einem Dilemma.
http://www.bpb.de/gesellschaft/umwelt/bioethik/176364/tierethische-positionen?p=all
Die Deutsche Forschungsgemeinschaft veröffentlichte im Jahr 2016 die neu aufgelegte Broschüre „Tierversuche in der Forschung“ und möchte mit den darin zusammengestellten Informationen einen Beitrag leisten zur „Versachlichung der kontrovers und oftmals emotional geführte Diskussion“ um das Thema. Darin ab Seite 21 ein Kapitel über ethische Abwägungen und ab Seite 28 ein kurzes Kapitel über den aktuellen Stand der Genomforschung an Versuchstieren. Die Rahmenbedingungen für die Beantragung und Durchführung von Tierversuchen im allgemeinen in Deutschland sind ab Seite 59 erläutert.
8. Xenotransplantation: tierische Organe für den Menschen
Als Xenotransplantation bezeichnen wir die Übertragung lebens- und funktionsfähiger Zellen, Gewebe und Organe von einer Spezies auf die andere (Tier-Mensch). Hiervon abzugrenzen ist die Allotransplantation, bei der die Übertragung von Biomaterial zwischen Individuen derselben Spezies (Mensch-Mensch) erfolgt. Mit der Xenotransplantation wollen Wissenschaftler und Ärzte auf die begrenzte Verfügbarkeit menschlicher Spenderorgane reagieren.
Die Geschichte der Xenotransplantation reicht zurück bis ins 17. Jahrhundert
Die artübergreifende Transplantation ist keine Erfindung des letzten Jahrhunderts. Der erste klinische Fall einer Xenotransplantation geht auf Jean-Baptiste Denis zurück, der im Jahre 1667 eine Bluttransfusion von Tier zu Mensch durchführte. Im Laufe der Jahrhunderte wurden weitere tierische Organe auf den Menschen übertragen: Haut, Hornhaut, Hoden, Nieren, Herz und Leber.
In den 60er Jahren verpflanzte der Chirurg Keith Reemtsma Patienten mit Niereninsuffizienz Schimpansen-Nieren. Die Patienten stießen jedoch die transplantierten Organe ab und lebten nicht länger als neun Monate. Der Fall „Baby Fae“ sorgte in den 80er Jahren für großes Aufsehen. Der Chirurg Leonard Bailey transplantierte einem neu geborenen Baby, das mit einem lebensbedrohlichen Herzfehler zur Welt kam, ein Pavianherz. Die Abstoßungsreaktion war jedoch so stark, dass das Kind zwanzig Tage nach der Operation verstarb. Diese Barriere der Immunabwehr bei Xenotransplantationen wollen nun Wissenschaftler mithilfe der CRISPR-Technologie überwinden.
Ganz aktuell: Im August 2017 veröffentlichte das Fachmagazin „Science“ eine Studie, laut der US-Forschern mit der CRISPR-Cas-Methode die Zucht von Schweinen gelang, deren Gene keine Retroviren mehr enthalten, was einen wichtigen Schritt für die Transplantationsforschung von Schweine-Organen für Menschen bedeutet:
Link zum (kostenpflichtigen) Originalartikel: http://science.sciencemag.org/content/357/6357/1303
http://www.zeit.de/wissen/gesundheit/2017-08/crispr-gentechnik-organspende-schweine-transplantation
Weiterführende Literatur zur Xenotransplantation
- Aristizabal, A.M. et al. (2017): Clinical Xenotransplantation, a Closer Reality: Literature Review. In: Cir Esp. 95(2): 62-72.
http://www.elsevier.es/en-revista-cirugia-espanola-english-edition–436-pdf-S2173507717300297-S300 - Beckmann, J.P. (2000): Xenotransplantation von Zellen, Geweben oder Organen: Wissenschaftliche Entwicklungen und ethisch-rechtliche Implikationen. Wissenschaftsethik und Technikfolgenbeurteilung. Berlin: Springer.
- Chick,W.L./ Cooper, D.K./ Lanza, R.P. (1997): Xenotransplantation. In: Spektrum der Wissenschaft 9: 70. (online):
http://www.spektrum.de/magazin/xenotransplantation/824111 - Cooper, D.K. (2012): A brief history of cross-species organ transplantation. In: Proc (Bayl Univ Med Cent) 25(1): 49-57.
- Deutsches Primatenzentrum: Xenotransplantation – Forschung für neue Organersatzverfahren:
http://www.dpz.eu/de/abteilung/ueber-tierversuche/forschung/medizinische-therapien-auf-basis-von-tierversuchen/xenotransplantation.html - Deutsches Referenzzentrum für Ethik in den Biowissenschaften: Xenotransplantation: http://www.drze.de/im-blickpunkt/organtransplantation/module/xenotransplantation
- Grimm, H. (Hg.) (2003): Xenotransplantation. Grundlagen Chancen Risiken. Stuttgart: Schattauer.
- Lange, M. (2016): Mit Crispr/Cas Schweineorgane verändern. Hoffnung für die Xenotransplantation. In: Deutschlandfunk. (online)
http://www.deutschlandfunk.de/mit-crispr-cas-schweineorgane-veraendern-hoffnung-fuer-die.676.de.html?dram:article_id=368226 - Schicktanz, S. (2002): Organlieferant Tier? Medizin- und tierethische Probleme der Xenotransplantation. Frankfurt am Main: Campus.
- Straßburger, J. (2008): Rechtliche Probleme der Xenotransplantation. Internationale Regelungen und nationaler Regelungsbedarf unter besonderer Berücksichtigung des Infektionsrisikos. Kovac: Hamburg.
Zur ethischen Beurteilung von Xenotransplantationen
- Ach, J.S. / Anderheiden, M. / Quante, M. (2000): Ethik der Organtransplantation. Fischer: Erlangen.
- Ach, J.S. (1999): Warum man Lassie nicht quälen darf. Harald Fischer Verlag: Erlangen.
- Anderson, M. (2005): Xenotransplantation: a bioethical evaluation. In: J Med Ethics 32: 205-208.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2565783/pdf/205.pdf - Deutsches Referenzzentrum für Ethik in den Biowissenschaften: Ethische Beurteilung der Xenotransplantation
http://www.drze.de/im-blickpunkt/organtransplantation/module/ethische-beurteilung-der-xenotransplantation - Francione, G.L. (2003): Xenografts and Animal Rights. In: Armstrong, S.J./ Botzler, R.G. [ed.]: The Animal Ethics Reader. Routledge: London/ New York, 368-371.
- Frey, R.G. (2003): Organs for Transplant: Animals, Moral Standing, and One View of the Ethics of Xenotransplantation. In: Armstrong, S.J./ Botzler, R.G. [ed.]: The Animal Ethics Reader. Routledge: London/ New York, 359-367.
- Krebs, A. (1997): Naturethik im Überblick. In: Krebs, A. [ed.]: Naturethik – Grundtexte der gegenwärtigen tier- und ökoethischen Diskussion. Suhrkamp: Frankfurt am Main, 337-379.
- Singer, P. (2001): Xenotransplantation and Speciesism. In: Kuhse, H. / Singer, P. [ed.]: Bioethics: An Anthology. Oxfod [u.a.]: Blackwell, 412-417.
- Veatch, Robert M. (2000): Transplantation Ethics. Georgetown University Press: Washington D.C.
- Wolf, U. (1997): Haben wir moralische Verpflichtungen gegen Tiere? In: Krebs, A. [ed.]: Naturethik – Grundtexte der gegenwärtigen tier- und ökoethischen Diskussion. Suhrkamp: Frankfurt am Main, 47-75.
- ↑ nach oben
9. Das Wollhaar-Mammut: Wiederbelebung nach 700.000 Jahren?
Michael Crichton lässt grüßen. In seinem Roman „Jurassic Park“ zeichnet der US-amerikanische Schriftsteller (1942-2008) eine Zukunft, in der Wissenschaftler Dinosaurier zum Leben erwecken. Mit der CRISPR-Technologie scheint eine Wiederkehr ausgestorbener Lebewesen keine Utopie zu sein.
Während in „Jurassic Park“ Klone erzeugt werden, können Wissenschaftler in der realen Welt mit der CRISPR-Methode Gene synthetisieren und diese in das Genom eines Zielorganismus einpflanzen, aus dem sich schließlich ein Tier mit den gewünschten Merkmalen der ausgestorbenen Art entwickeln soll. Genau dieses Ziel verfolgt der Molekularbiologe George M. Church mit seinem Wollhaarmammut-Projekt.
Die Faszination für das heute ausgestorbene Wollhaarmammut (auch Fellmammut genannt), das die kaltzeitlichen Steppen Nordeuropas und Nordamerikas bewohnte, ist groß. Wir alle kennen das Mammut aus Schulbüchern und Museen oder hatten vielleicht sogar die Möglichkeit, Höhlenabbildungen aus Font-de-Gaume, Pech Merle oder Les Combarelles in Frankreich zu bewundern. Umso faszinierender empfinden wir die Funde des ausgestorbenen Mammuts. Kein Wunder also, dass Wissenschaftler das Wollhaarmammut gerne wiederbeleben möchten.
- Spiegel Online (2015): Bauer entdeckt Knochen Riesen-Mammut unterm Acker (Video):
http://www.spiegel.de/video/mammut-fund-in-michigan-skelett-von-wollhaarmammut-video-1613918.html - Herridge, T. (2014): Mammoths are a huge part of my life. But cloning them is wrong. In: The Guardian, https://www.theguardian.com/commentisfree/2014/nov/18/mammoth-cloning-wrong-save-endangered-elephants
- Worrall, S. (2017): Wie wir das Wollhaarmammut wieder zum Leben erwecken. In: National Geographic, http://www.nationalgeographic.de/wissenschaft/2017/08/wie-wir-das-wollhaarmammut-wieder-zum-leben-erwecken
- Devlin, H. (2017): Woolly mammoth on verge of resurrection, scientists reveal. In: The Guardian, https://www.theguardian.com/science/2017/feb/16/woolly-mammoth-resurrection-scientists
10. Gene Drive – der Vererbungsturbo
Der Begriff Gene Drive (zu deutsch: Genantrieb, auch „Vererbungsturbo“) bezeichnet eine Methode zur schnellen Verbreitung gentechnisch veränderter Gene und damit bestimmter Eigenschaften in einer Population von Lebewesen. Die neuen Methoden zur Genom-Editierung wie CRISPR-Cas erlauben sehr umfassende und weitreichende EIngriffe in die Ökosysteme.
Der Deutsche Ethikrat widmete seine Herbsttagung 2017 dem Thema „Gene-Drive – Vererbungsturbo in Medizin und Landwirtschaft“ und umreißt das Thema und die sich hier stellenden drängenden Fragen wie folgt:
„Neue Techniken der sogenannten Genom-Editierung wie CRISPR-Cas9, die besonders präzise und effiziente Eingriffe in das Erbgut erlauben, ermöglichen aktuell erstmals die biotechnologische Entwicklung und Anwendung von Gene-Drives. Das Ziel ist, gentechnische Veränderungen schnell in freier Wildbahn zu verbreiten und so den Genpool von Populationen zu beeinflussen.
Da sich mithilfe von Gene-Drives auch Merkmale verbreiten lassen, die zu verminderter Fruchtbarkeit führen, kann die Technologie auch zur Dezimierung von Populationen eingesetzt werden – theoretisch bis hin zur Ausrottung ganzer Arten.
Wegen ihrer raschen Generationenfolge sind es derzeit vorwiegend Insekten, an denen Eingriffe mit Gene-Drive-Systemen erforscht werden. Eine ganze Reihe von Projekten zielt auf die Bekämpfung von Insekten ab, die gesundheitliche oder landwirtschaftliche Schäden verursachen.
Beispielsweise sollen mit Gene-Drives Populationen von Mücken kontrolliert werden, die Krankheiten wie Malaria übertragen. Untersucht werden sowohl die radikale Möglichkeit, den Malaria-Erreger übertragende Mückenarten regional (oder sogar global) auszulöschen, als auch gentechnische Veränderungen, die die Weiterentwicklung des Erregers in der Mücke unterbinden und damit letztlich seine Übertragung auf den Menschen verhindern.
Den mit Anwendungen von Gene-Drive-Systemen verbundenen Chancen stehen allerdings schwer überschaubare ökologische Risiken sowie rechtliche und ethische Bedenken gegenüber. Mit seiner Veranstaltung möchte der Ethikrat daher einen Anstoß geben, über Fragen wie die folgenden zu diskutieren:
- Welche Sicherungsmechanismen sind erforderlich, damit die Freisetzung mittels Gene-Drive veränderter Organismen keine schädlichen Auswirkungen auf Mensch und Umwelt hat?
- Dürfen Versuche mit Gene-Drives allein aufgrund nationaler Regelungen durchgeführt werden, oder braucht es hierfür aufgrund der grenzüberschreitenden Auswirkungen internationale Vereinbarungen?
- Rechtfertigt die Bekämpfung von Hunger und Infektionskrankheiten die gezielte Ausrottung ganzer Arten?“
Eine aktuelle Pressemitteilung fasst die Beiträge der Tagung übersichtlich zusammen:
http://www.ethikrat.org/presse/pressemitteilungen/2017/pressemitteilung-07-2017
Die Präsentationen der ReferentInnen sowie die Audioprotokolle der Diskussionen sind auf der Seite des Ethikrates abrufbar:
Unter http://www.ethikrat.org/veranstaltungen/weitere-veranstaltungen/gene-drive
Das Fazit der Schlussdiskussion verdeutlicht „dass die Öffentlichkeit in den gesellschaftlichen Diskurs einbezogen und internationale Regelungsansätze verfolgt werden müssen. Darüber hinaus soll die interdisziplinäre Forschung zum Thema Gene-Drive weiter vorangetrieben werden. Dabei sei das Vorsorgeprinzip, das in diesem Fall vor allem fordere, noch eingreifen zu können, wenn etwas schiefgeht, die oberste Maxime.“
11. Gesetzlicher Rahmen: Was ist national und international erlaubt?
Das Deutsche Gentechnikgesetz ist einsehbar auf den Seiten des Bundesministeriums für Ernährung und Landwirtschaft.
http://www.gesetze-im-internet.de/gentg/
Das Deutsche Clearing House for Biosafety (https://biosicherheit-bch.de/BCH/DE/Aufgaben/aufgaben_node.html) stellt eine Übersicht zur Verfügung bzgl. der rechtlichen Grundlagen in Deutschland, Europa und auf der internationalen Ebene.
https://biosicherheit-bch.de/BCH/DE/RechtlicheGrundlagen/rechtlicheGrundlagen_node.html
Wie dort erwähnt, gilt auf internationaler Ebene als zwischenstaatliches Abkommen das „Cartagena Protokoll zur Biologischen Sicherheit“, welches ein Zusatzprotokoll zur Konvention über Biologische Diversität ist. Seit seinem Inkrafttreten im Jahr 2003 haben bis heute 171 Staaten das Protokoll ratifiziert. Seine Bedeutung wird hier erläutert:
Weiterführend sei die englischsprachige Seite der „Convention on Biological Diversity“ empfohlen. Dort heißt es:
The Cartagena Protocol on Biosafety to the Convention on Biological Diversity is an international agreement which aims to ensure the safe handling, transport and use of living modified organisms (LMOs) resulting from modern biotechnology that may have adverse effects on biological diversity, taking also into account risks to human health.
Hier auch ein Papier aus dem Deutschen Bundestag, das die Antworten der Bundesregierung auf eine kleine Anfrage enthält. Es beinhaltet einige inhaltliche Informationen und politische Positionen zur Einstufung von und zum Umgang mit neuen Gentechnikverfahren:
http://dip21.bundestag.de/dip21/btd/18/103/1810301.pdf
Aktuell herrscht rechtlich noch keine Einigkeit, ob sogenannte editierte Organismen, die durch das CRISPR-Cas-Verfahren verändert wurden, als gentechnisch veränderte Organismen (GVO) einzustufen sind. Kontrovers diskutiert wird, ob die so erzeugten Organismen als GVO gelten, da gentechische Methoden zur Anwendung kommen, oder nicht, da sie kein fremdes genetisches Material enthalten und so nicht von natürlichen, zufälligen Mutationen unterscheidbar sind. Diese Frage liegt derzeit dem Europäischen Gerichtshof (EuGH) in Luxemburg vor, dessen Entscheidung aber nicht vor 2018 erwartet wird.
12. Bekämpfung von Mückenarten mittels Gene Drive
Es erscheint verlockend, durch die Anwendung von Gene Drives, bei denen eine für das Fortbestehen einer Art nachteilige Eigenschaft sehr schnell in der Population weitergegeben wird, lästige und für den Menschen gefährliche Organismen zu bekämpfen, womöglich sogar auszurotten.
Auf der Seite des MIT-Forschers Kevin M. Esvelt wird erklärt und mittels eines kurzen Videos (ca. 2,5 min) gezeigt, wie dieser Ansatz funktioniert (in englischer Sprache).
http://www.sculptingevolution.org/genedrives
Wo werden Gene Drives aktuell angewendet?
Einen guten und knappen Überblick zum Stand der Anwendung von Gene Drives liefert das Laborjournal:
http://www.laborjournal.de/rubric/methoden/methoden/v162.lasso
Gerade Arten, die z.B. den Malaria-Erreger oder das Zika-Virus übertragen, Anopheles gambiae (https://de.wikipedia.org/wiki/Anopheles_gambiae) und Aedes aegypti (https://de.wikipedia.org/wiki/Gelbfieberm%C3%BCcke) eignen sich besonders gut für die Anwendung von Gene Drives. Die Mücken haben sehr kurze Generationszyklen, was die Ausbreitung der Gene in der Population beschleunigt – und kaum einer mag sie und hätte etwas gegen ihre Ausrottung einzuwenden. Jedoch birgt die Methode auch Risiken:
Warum Mücken nicht einfach ausgerottet werden sollten
Im Gespräch des Deutschlandfunks mit der Bioethikerin Uta Eser plädiert diese für eine vorsichtige Herangehensweise anstatt für die „Holzhammermethode Gene Drive“, denn erstens können damit unvorhergesehene Folgen in den Ökosystemen einhergehen und zweitens befürchtet sie einen zügigen Dammbruch-Prozess, bei dem schnell weitere Arten ins Visier der neuen Methoden geraten, um mitten ihnen einhergehende Probleme vermeintlich einfach aus der Welt zu schaffen – und wie weit soll dies gehen? Und wer entscheidet darüber?
Auch die Mikrobiologin Shannon Bennett plädiert zur Vorsicht, wenn es um die verlockend erscheinende Ausrottung von Arten geht, die der Mensch überwiegend als schädlich empfindet.
Denn auch Mücken haben ihren Platz und ihre Funktionen (z.B. als Nahrung anderer Arten und als Bestäuber) in den Ökosystemen. Die gezielte Ausrottung ganzer Arten darf keine leichtfertige Entscheidung sein, sondern ihre Auswirkungen und mögliche andere Lösungen müssen umfassend untersucht werden:
http://www.biographic.com/posts/sto/the-zika-challenge
Zusatzmaterialien als PDF zum Herunterladen
Die Materialien wurden zum Zugriffszeitpunkt 09.11.2017 erstellt von:
Volker Mosbrugger, Petra Gehring, Sybille Roller, Francesco Lupusella, Julia Krohmer, Rebecca Spitzenberger
